新闻中心
【佑安学术】探索未知,佑安专家在国际著名肿瘤学杂志发表文章揭示外泌体与肝细胞癌关系
外泌体是由活细胞分泌的,直径约30-150nm的有膜小囊泡。1985年Johnstone 研究组首次在体外培养的绵羊红细胞上清中发现,并于1987年命名为外泌体(Exosome)。美国科学家Rothman, Schekman和德国科学家Südhof因发现了囊泡(外泌体)准确转运物质的调控机制,共同获得了2013年诺贝尔生理学或医学奖,外泌体开始迅速发展。外泌体内包含大量来源细胞的蛋白、DNA、RNA等,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等多方面发挥作用。
近期,首都医科大学附属北京佑安医院普外中心的李宁教授,北京市肝病研究所的李伟华研究员作为共同通讯作者在国际著名肿瘤学杂志期刊《Molecular cancer》在线发表了题为“The significance of exosomes in the development and treatment of hepatocellular carcinoma”的综述文章(图1,影响因子10.679分)。该篇文章第一作者为北京佑安医院2018级硕士研究生李鑫。本文章获得国家自然基金等基金的资助。

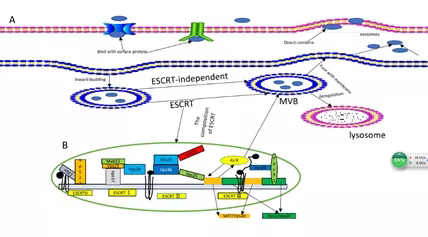
该文章首先讲述了外泌体从发生到成熟的详细过程,重点介绍了外泌体合成过程中内吞体分选转运复合体(ESCRT)形成的重要机制,ESCRT由四种核心成分组成,包括ESCRT 0,I,II和III,该文在总结大量文献的基础上绘制出了ESCRT的详细结构,以及内部分子之间的相互作用关系,ESCRT的主要功能是提供泛素化的蛋白质以诱导溶酶体降解和蛋白质再利用。在上述过程中,相互作用蛋白X(ALIX)在与ESCRT-III亚基SNF7相互作用中起重要作用(图2)。
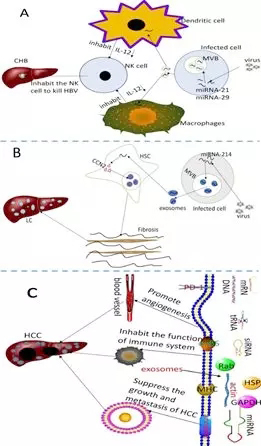
随后文章概述了外泌体在慢性乙型肝炎、肝硬化、肝癌各个阶段的作用,以及从慢乙肝到肝细胞癌,外泌体在其中可能的作用机制(图3)。HBV病毒感染肝细胞后,会诱导被感染的肝细胞释放含有miRNA-21和miRNA-29外泌体,来抑制巨噬细胞和树突状细胞并释放IL-12。IL-12能激活自然杀伤(NK)细胞,上述过程抑制IL-12释放,从而破坏先天免疫反应,导致乙型肝炎的慢性感染。肝星状细胞分泌的外泌体中含有大量结缔组织生长因子2CCN2,而外泌体可以利用miR-214相互作用细胞穿梭,从而调节(CCN2)的形成,CCN2可以激活肝纤维化的形成,上述过程不断累积最终导致肝硬化的发生。外泌体在肝癌的发生、发展、浸润、转移过程中起到了非常重要的作用,在肝癌的血管形成、肿瘤微环境等方面也发挥了重要的作用。
最后从肝癌的临床应用方面,综述了外泌体在诊断、治疗等方面的重要作用。由于外泌体有脂质膜保护,其内容物如DNA、RNA 和蛋白质不易被降解破坏,更重要的是,外泌体可以从各种体液中获得(血液、尿液等),这使得外泌体在肿瘤检测中极具前途,现已经成为疾病诊断的新型靶标。另外,外泌体能够穿越屏障,如细胞质膜、血/脑屏障,这使得它可以作为药物的载体,用于靶向肿瘤治疗。
通讯作者简介
李伟华,首都医科大学附属北京佑安医院肝病研究所研究员,硕士生导师,医学博士,副教授。北京卫生系统技术人才学科骨干。
世界中医药学会联合会艾滋病专业委员会理事;中华中医药学会防治艾滋病分会委员;中华中医药学会中国性病艾滋病防治协会学术委员会中医学组成员;北京市中医药学会中医应急工作委员会秘书长。国家自然科学基金、北京市自然科学基金,首都医学发展科研基金等项目评审专家。主持国家自然科学基金,北京市科委,北京市中医药管理局等10余项课题。发表论文30余篇,参编论著4部。获北京丰台区科技成果一等奖。获计算机软件登记著作权1项。申请国家专利1项。
第一作者简介:李鑫,首都医科大学附属北京佑安医院普通外科中心硕士研究生,主要从事肝细胞癌的早期诊断以及MVI的早期诊断和治疗。











 京公网安备11010602050066号
京公网安备11010602050066号



